آنتی بادی ها بخش مهمی از سیستم ایمنی هستند. هنگامی که بدن با یک آنتی ژن آلوده می شود، سیستم ایمنی آنتی بادی مخصوص آن آنتی ژن را تولید می کند. تکنیک هایی که به طور معمول در بیوتکنولوژی مورد استفاده قرار می گیرند، از این فرآیند ایمنی طبیعی بهره می برند. آنتی بادی ها در بسیاری از کاربردهای تحقیقاتی و همچنین در سنجش ایمنی برای تشخیص بیماری استفاده می شوند. از ویژگی اتصال آنتی ژن/آنتی بادی برای تشخیص ایمنی زایی و سنجش الایزا استفاده می شود. ما از آنتی بادی های کونژوگه با فلوروفور یا برچسب آنزیمی برای برچسب زدن اهداف مولکولی روی سلول ها و کل بافت استفاده می کنیم. از خالص سازی آنتی بادی برای تشخیص بیماری استفاده می شود. این آنتی بادی ها بسته به کاربرد، معمولاً از طریق خالص سازی آنتی بادی از انسان، موش، خرگوش و مرغ به دست می آیند.
آنتی بادی های پلی کلونال در مقابل مونوکلونال
آنتی بادی هایی که ما استفاده می کنیم از سرم (آنتی بادی های پلی کلونال) از رده سلولی هیبریدوما (آنتی بادی های مونوکلونال) به دست می آیند. آنتی بادی های پلی کلونال از سلول های B مختلف جمع آوری می شوند، به این معنی که تنوع بیشتری در تشخیص اپی توپ آنتی ژن وجود دارد. آنتی بادی های مونوکلونال برای یک آنتی ژن خاص یکسان هستند و همه اپی توپ یکسان را تشخیص می دهند. نوع آنتی بادی مورد نظر به اهداف روش مورد نظر بستگی دارد.
سه روش اصلی برای خالص سازی آنتی بادی
برای خالص سازی آنتی بادی، تطبیق روش خالص سازی با نوع آنتی بادی و هدف مورد نظر ضروری است. سه روش اصلی برای خالص سازی آنتی بادی وجود دارد. عمومی ترین روش با اختصاصیت کمتر در تخلیص انتی بادی روش جداسازی ساده آنتی بادی ها از سایر پروتئین ها بر اساس اندازه و ساختار است. این روش منجر به خالص سازی تمام آنتی بادی ها صرف نظر از نوع و اتصال آنتی ژن می شود. گام بعدی در ویژگی جداسازی یک کلاس خاص از آنتی بادی ها است (مانند IgG، IgM، IgA، IgL، IgE ) این کار با استفاده از پروتئین هایی مانند پروتئین A یا G انجام می شود که به کلاس های خاصی از آنتی بادی ها وابسته هستند. خاص ترین روش خالص سازی آنتی بادی، جذب اختصاصی آنتی ژن است. این روش اغلب مستلزم این است که آنتی ژن به یک تکیه گاه جامد متصل شود. Magnetic beads به ویژه برای خالص سازی آنتی بادی اختصاصی آنتی ژن و کلاس خاص مفید هستند. به طور سنتی، ستونها یا مهرههای رزینی به عنوان تکیهگاه جامد استفاده میشوند.به این صورت که آنتی بادی به آنتی ژن یا پروتئین خاصی جذب و سپس جمع آوری می شود. اتصال آنتی بادی در pH فیزیولوژیکی مؤثرتر است. اگر PH تا حد زیادی افزایش یا کاهش یابد، اتصال بین آنتی بادی و آنتی ژن یا آنتی بادی و پروتئین دچار اختلال خواهد شد. سپس آنتی بادی از ستون شسته میشود و میتوان آن را برای تکمیل فرآیند تخلیص آنتیبادی جمعآوری کرد. اگر نشود پروتئین جذب شده را روی یک تکیه گاه جامد تثبیت کرد، در این صورت گزینه ای برای استفاده از پروتئین فیوژن یا برچسب HIS6 هیس تگ (اسید آمینه هیستیدین) وجود دارد.
روشهای تخلیص آنتیبادی کمتر سختگیرانه را میتوان برای جمعآوری آنتیبادیهای مونوکلونال از رده سلولی هیبریدوما استفاده کرد، زیرا منبع بسیار کنترلشده ای است. در مقابل آنتی بادی های پلی کلونال به سخت ترین روش های تصفیه اختصاصی آنتی ژن نیاز دارند زیرا پروتئین ها و آنتی بادی های زیادی در سرم وجود دارد. ایمونواسی بخش مهمی از علوم زیستی است و بدون استراتژی های خالص سازی آنتی بادی که دسته های ثابت و قابل اعتمادی از آنتی بادی ها را تولید می کند، امکان پذیر نخواهد بود.
بطور کلی روش های تخلیص آنتی بادی
- Physicochemical fractionation antibody purification
در روش Physicochemical fractionation—differential precipitation براساس حذف اندازه یا اتصال فاز جامد ایمونوگلوبولین ها بر حسب اندازه، بار، یا سایر ویژگی های شیمیایی مشترک آنتی بادی ها در نمونه های معمولی است که این باعث جداسازی زیر مجموعه ای از پروتئین های نمونه می شود که شامل ایمونوگلوبولین ها ست.
زیر مجموعه های این روش عبارتند از :
1.Size exclusion chromatography
- Ammonium sulfate precipitation
- Ion exchange chromatography
- Immobilized metal chelate chromatography
- Thiophilic adsorption
- Melon Gel chromatography
- دیالیز، نمک زدایی و دیافیلتراسیون را می توان برای تبادل آنتی بادی ها به بافرهای خاص و حذف اجزای ناخواسته با وزن مولکولی پایین( MW )استفاده کرد. غشاهای دیالیز، رزینها، و دستگاههای دیافیلتراسیون که دارای cut off با وزن مولکولی بالا (MWCO) هستند، میتوانند برای جداسازی ایمونوگلوبولینها (> 140 کیلو دالتون) از پروتئینها و پپتیدهای کوچک استفاده شوند. این تکنیکها به تنهایی نمیتوانند آنتیبادیها را از سایر پروتئینها و ماکرومولکولهایی که در نمونههای آنتیبادی معمولی وجود دارند، خالص کنند و تنها با استفاده از ستونها و تجهیزات تخصصی تخلیص امکان پذیر است. به طور معمول، فیلتراسیون ژل و دیالیز به دنبال سایر مراحل خالص سازی، مانند رسوب سولفات آمونیوم استفاده می شود.
- رسوب سولفات آمونیوم اغلب برای غنی سازی و تغلیظ آنتی بادی های سرم، مایع آسیت یا مایع رویی کشت سلولی استفاده می شود. آنتی بادی ها در غلظت های کمتر سولفات آمونیوم نسبت به سایر پروتئین ها و اجزای سرم رسوب می کنند. این روش خالص سازی برای برخی کاربردهای آنتی بادی مناسب است ، اما اغلب به عنوان یک مرحله مقدماتی قبل از کروماتوگرافی ستونی یا سایر روش های خالص سازی انجام می شود.
- در کروماتوگرافی تبادل یونی (IEC) از رزین های دارای بار مثبت یا منفی برای اتصال پروتئین ها بر اساس بارهای خالص آنها در یک سیستم بافر معین (pH) استفاده می شودIEC یک روش مقرون به صرفه، آرام و قابل اعتماد برای تخلیص آنتی بادی است.
- کروماتوگرافی تمایل فلزی یا کلات فلزی ثابت (IMAC) از یون های فلزی دو ظرفیتی مثل نیکل برای اتصال پروتئین ها یا پپتیدهایی که به دنبال انها هیس تگ (هیستیدین متوالی) وجود دارد استفاده می شود( اغلب در پروتئین های نوترکیبی که مهندسی شده اند وجود دارد ). جالب اینجاست که IgGهای پستانداران یکی از معدود پروتئینهای فراوان در سرم (یا رویی کشت سلولی هیبریدوما مونوکلونال) حاوی اسید امینه های هیستیدین هستند که میتوانند به نیکل ثابت متصل شوند. تعدادی از یون های فلزی دیگرمثل کبالت ، منیزیوم ، روی ، کلسیم و آهن بعنوان لیگاند در کروماتوگرافی تمایل فلزی مورد استفاده قرار می گیرد.
- Class-specific affinity purification of antibodies
روش میل ترکیبی طبقه ای - اتصال فاز جامد کلاس های آنتی بادی خاص مانند( IgG ) توسط لیگاندهای بیولوژیکی ثابت (پروتئین ها، لکتین ها و غیره) که میل ترکیبی خاصی به ایمونوگلوبولین ها دارند. در این روش همه آنتی بادی های کلاس هدف بدون توجه به ویژگی آنتی ژن خالص می شود.
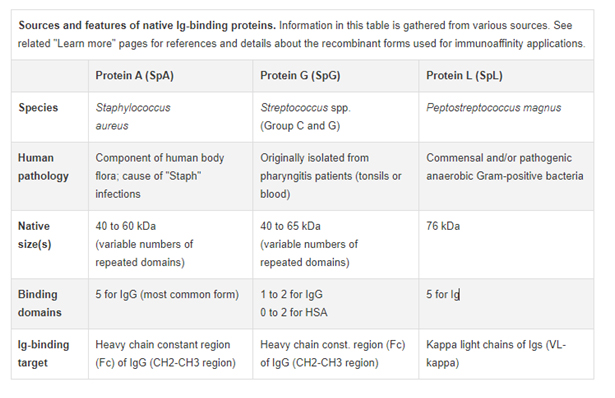
Protein A, G, and L antibody-binding ligands
پروتئینهای A، G و L سه پروتئین باکتریایی هستند که خواص اتصال آنتی بادی آنها به خوبی مشخص شده است. این پروتئین ها به صورت نوترکیب تولید شده اند و به طور معمول برای خالص سازی میل ترکیبی انواع آنتی بادی های کلیدی از گونه های مختلف استفاده می شوند. بیشتر اشکال نوترکیب این پروتئینها که به صورت تجاری در دسترس هستند، توالیهای غیرضروری آنها حذف شدهاند از جمله دامنه اتصال HSA از پروتئین G بنابراین کوچکتر از همتایان بومی خود هستند. یک شکل نوترکیب دستکاری شده ژنتیکی از پروتئین A و پروتئین G به نام پروتئین A/G نیز به طور گسترده در دسترس است. هر چهار پروتئین نوترکیب متصل شونده به Ig به طور معمول توسط محققان در بسیاری از کاربردهای تشخیصی و ایمنی استفاده می شوند.
زیر مجموعه های این روش عبارتند از :
- Antibody purification with Protein A, G, and L
- IgM purification
- IgA purification
- Chicken IgY purification
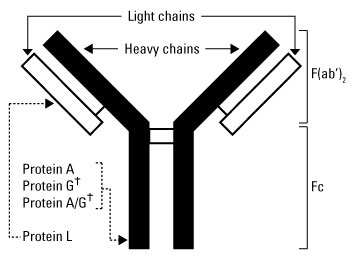
- برای تخلیص آنتی بادی با پروتئین های A، G، A/G یا L، آنها به صورت کووالانسی روی رزین های متخلخل یا دانه های مغناطیسی ثابت می شوند. از آنجایی که این پروتئینها حاوی چندین دومین اتصالی با آنتیبادی هستند، تقریباً هر مولکول ثابت شده، بدون توجه به جهت ، حداقل یک دومین اتصال عملکردی و بدون مانع را حفظ میکند. علاوه بر این، از آنجایی که پروتئینها به آنتیبادیها در قسمت هایی غیر از دومین اتصال آنتیژن متصل میشوند، از این پروتئینها میتوان در تخلیص استفاده کرد. پروتئین های A، G، A/G و L دارای خواص اتصال متفاوتی بوده که هر کدام را برای انواع مختلفی از اهداف آنتی بادی مناسب می کند. توجه به این نکته مهم است که استفاده از پروتئین A، G یا L منجر به خالص سازی ایمونوگلوبولین عمومی از یک نمونه خام می شود.
- برای IgM آنتی بادی های کلاس M که دارای نوع مناسب زنجیره سبک (VL-kappa) هستند، می توان از پروتئین L برای خالص سازی استفاده کرداگر چه ، IgG هایی که دارای همان نوع زنجیره سبک هستند، نیز خالص می شوند.خالص سازی در مقیاس صنعتی و تجاری برای این کلاس از آنتی بادی ، ترکیبی از تکنیک ها استفاده می شود .
- لکتین یک گلیکوپروتئین به وزن تقریباً 40 کیلو دالتون است که از چهار زیر واحد یکسان تشکیل شده است. در خالص سازی سرم انسانی یا IgA ترشحی مفید است. لیگاند میل ترکیبی، تصفیه یا حذف IgA را از IgG و IgM فراوانتر در سرم یا آغوز انسان ممکن میسازد.
- جوجه ها یک مولکول ایمونوگلوبولین منحصر به فرد به نام IgY تولید می کنند. مرغها ۱۵ تا ۲۰ برابر بیشتر از خرگوشها آنتیبادی تولید میکنند. یک زرده تخم مرغ از یک مرغ واکسینه شده ،حاوی تقریباً 300 میلی گرم IgY است. تخممرغهای کامل یا زردههای تخممرغ جدا شده را میتوان جمعآوری و به صورت منجمد نگهداری کرد تا بعدآنتیبادی آن را استخراج شود.
- Antigen-specific affinity purification of antibodies
در این روش تمام آنتی بادی هایی که به آنتی ژن متصل شده اند بدون توجه به کلاس یا ایزوتیپ آنتی بادی خالص می شود. اگرچه پروتئینهای A، G، A/G و L لیگاندهای بسیار مهمی برای تخلیص کل IgG از یک نمونه هستند اما در بیشتر موارد به خالصسازی آنتیبادیهای اختصاصی آنتیژن نیاز است. در این روش با ثابت کردن آنتی ژن خاص (که برای ایمن سازی استفاده می شود )آن دسته از آنتی بادی هایی که به طور اختصاصی به آن آنتی ژن متصل می شوند ،تخلیص می گردند.
- Antigen immobilization and presentation
- Peptide antigens and affinity ligands
- Protein antigens and affinity ligands
- Binding and elution conditions
روش ها و درجه خلوص برای بدست آوردن آنتی بادی به کاربرد های مورد استفاده از آن آنتی بادی بستگی دارد.