بیان ژن بیگانه در میزبان و مشکلات مربوط به آن
کلون سازی ژن به این مفهوم است که یک ژن با اهمیت که مسئول سنتز پروتئین ویژه ای است از میزبان اصلی خود خارج شده ودر یک ناقل کلون سازی جای گیردو به درون میزبان جدید منتقل شود . در اینجا به میزبان پروکاریوتی پرداخته شده است .یکی از شناخته شده ترین میزبان های باکتریایی برای کلون سازی و در مهندسی ژنتیک باکتری اشریشیا کولای است . کلون کردن ژن بصورت مطلوب به عوامل متعددی نیاز دارد .زمانی که یک ژن بیگانه به منظور بیان وارد میزبان جدید می شود باید ان ژن به درستی توسط عوامل دخیل در رونویسی و ترجمه ی میزبان شناسایی شود . بعنوان مثال ژن هایی که بطور طبیعی در باکتری ای کولای وجود دارند دارای سه شاخصه ی مهم می باشند :
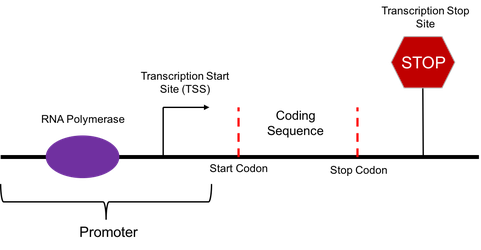
- پروموتور
- ترمیناتور
- جایگاه اتصال ریبوزوم
پروموتور قسمتی از ژِن می باشد که برای شروع رونویسی حیاتی است و ار ان ای پلیمراز برای شروع رونویسی این قسمت را شناسایی می کند .
ترمیناتور قسمت پایانی ژن می باشد که نقطه خاتمه ی رونویسی را اعلام کرده و معمولا ساختار سنجاق سری ایجاد می کند .
محل اتصال ریبوزوم قسمتی از ژن است که محل اتصال ام ار ان ای به ریبوزوم را مشخص می کند .
زمانی که ژن خارجی( یوکاریوتی ) به داخل باکتری انتقال می یابد ، غیر فعال است زیرا علایم بیان آن توسط باکتری قابل شناسایی نیست .

ابزار لازم برای انتقال ژن خارجی به داخل میزبان، حامل می باشد Expression Vector یا حامل بیانی برای تولید پروتئین نوترکیب در میزبان ضروری است.یکی از اجزای حیاتی حامل بیانی ، پروموتر می باشد . در این مبحث بیشتر به این موضوع پرداخته می شود .
پروموتر ها برای اولین مرحله بیان ژن یعنی اتصال RNA پلیمراز به DNA لازم هستند علاوه بر ان سرعت تولید mRNA وبه دنبال آن میزان پروتئین نوترکیب را تعیین می کنند. پروموتر های قوی سرعت بالایی از رونویسی را ایجاد می کنند و کنترل کننده ی ژن هایی هستند که محصولات آنها برای سلول بسیار ضروری هستند. واضح است که حامل های بیانی به منظور رونویسی بالای ژن خارجی باید پروتئین قدرتمندی داشته باشند. پروموتر ها قابلیت تنظیم شدن را دارند . تنظیم ژنی در E.coli به دو صورت Induction و Repression می باشد . در صورتی که با اضافه شدن ماده شیمیایی به محیط میزان رونویسی افزایش پیدا کند تنظیم از نوع القائی است و اگر اضافه شدن ماده ی شیمیایی کاهش میزان رونویسی را موجب شود تنظیم از نوع مهاری است.این مواد شیمیایی اغلب توسط ژن کد گذاری می شوند .
متداول ترین پروموتر هایی که در حامل های بیانی استفاده می شوند عبارتند از : پروموتر Lac ، پروموتر trp ، T7
پروموترlac: رونویسی ژن LacZ را که در حامل های pUC و M13mp راکنترل میکند و با ایزوپروپیل تیو گالاکتوزید القا میشود .
پروموتر trp : در بالادست چند ژن کد کننده ی آنزیمهای بیو سنتز تریپتوفان قرار دارد. این پروموتر در حضور تریپتوفان خاموش و در حضور 3 بتا ایندول آکریلیک اسید القا میشود.
پروموترT7 : این پروموتر مرتیط با RNA پلیمراز با کتریوفاژ T7 است و بسیار بیان بالایی را ایجاد میکند .
علاوه بر پروموتر قوی و قابل تنظیم برای داشتن حامل بیانی با کار ایی بالا نیاز به توالی اتصال به ریبوزوم باکتری E.coli و ترمیناتور دارد .
https://www.addgene.org/mol-bio-reference/promoters/
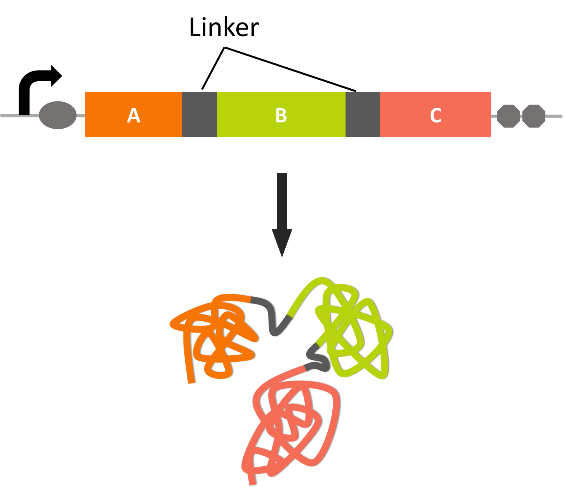
حامل های بیانی علاوه بر داشتن یک پروموتر قوی نیازمند به وجود سایت اتصال ریبوزوم و ترمیناتور (در انتها) هستند . هنگامی که ژن خارجی در بین جایگاه برشی در حامل قرار می گیرد ژن هیبریدی ایجاد می شود که در ابتدای آن بخشی از ژن E.coli قرار دارد .هنگامی که رونویسی انجام می شود mRNA حاصل صرفا شامل کدون های ژن بیگانه نیست و در قسمت ابتدایی آن ، کدون ژن موجود در حامل نیز وجود دارد .پس از ترجمه پروتئین حاصل بصورت فیوژن می باشد که قسمت کوتاهی از پروتئین دیگر در قسمت N ترمینال پروتئین وجود دارد. در برخی موارد دو ژن خارجی که پروتئینهای انها بصورت فیوژن ایجاد می شوند و توسط لینکر به هم اتصال دارند مد نظر هستند. توسط مزیت فیوژن پروتئین در این است که پایداری مولکول را افزایش می دهد و از هضم شدن آن توسط میزبان جلوگیری می کند . علاوه براین زمانی که قسمت اضافه شده مربوط به یک پپتید نشانه باشد که مسئول هدایت پروتئین نوترکیب را به محیط کشت یا فضای پری پلاسمی است و این موضوع در خالصسازی پروتئین نوترکیب بسیار حائز اهمیت است.زیرا بخش باکتریایی می تواند در کروماتوگرافی تمایلی موثر بوده و به تخلیص کمک کند بعنوان مثال فیوژن های دارای پروتئین گلوتاتیون _S_ ترانسفراز را میتوان با استفاده از دانه های آگارزی که گلوتاتیون به آن ها متصل شده است ، جداسازی کرد. در کنار مزیت های گفته شده ، ایراداتی نیز به این سیستم وارد است از جمله اینکه ممکن است ماهیت پروتئین نوترکیب تغییر کند . بنابر این باید ان بخش اضافی توسط مواد شیمیایی یا آنزیم هایی که توانایی برش را دارند ،حذف گردد. مثلا اگر یک متیونین در نقطه اتصال وجود داشته باشد، پروتئین حاصل را میتوان با سیانوژن برماید برش داد. یا آنزیم های ترومبیناز یا فاکتور Xa برای برش بخشهای باکتریایی استفاده میشوند.
علیرغم وجود حامل های بیانی بسیار مناسب و کارامد هنوز مشکلات عدیده ای برای تولید پروتئین های خارجی در E.coli وجود دارد .
مشکلات معمول تولید پروتئین نوترکیب در E.coli
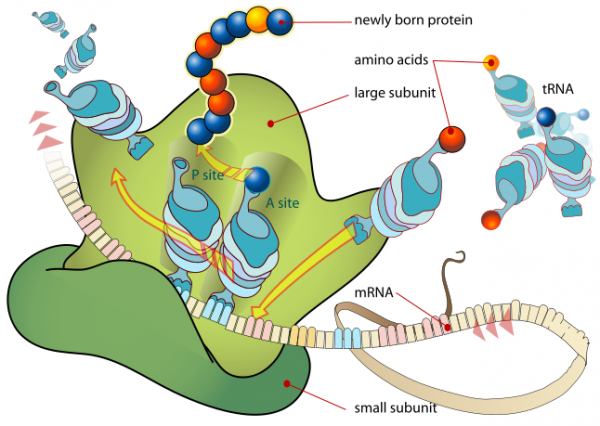
توالیهای نوکلئوتیدی در چند حالت مانع از بیان مناسب ژن کلون شده در باکتری ای کولای میشوند:
1.اگر ژن خارجی یوکاریوتی بوده و دارای اینترون باشد، زیرا ژن های باکتری فاقد اینترون است و قابلیت حذف اینترون از رونوشت را ندارد.راه حل این موضوع استفاده از DNA مکملmRNA است که فاقد اینترون ها هستند .
- اگر در ژن خارجی توالی هایی موجود باشد که به منزله ی پایان رونویسی باشد . این توالی ژن در میزبان کاملا طبیعی بوده و بی مفهوم هستند اما در باکتری موجب خاتمه و عدم بیان پروتئین می شود.راه حل مناسب این مشکل ، استفاده از جهش زایی در in vitro است که می توان موجب تغییر توالی ترمیناتور ها و جایگزین کردن کدون های نادر با کدون های مورد تمایل باکتری
- با توجه به اینکه تمامی موجودات از یک نوع کد ژنتیکی استفاده می کنند اما در هر موجودی نسبت به برخی کدون خاص تمایل بیشتری وجود دارد .اگر ژن بیگانه تعداد زیادی کدون نادر داشته باشد نتیجه ان کاهش مقدار پروتئین خواهد بود .
- در باکتری پردازش به درستی صورت نمی گیرد. پروتئین های اکثر موجودات زنده پس از ترجمه، پردازش می شوند ، که شامل ایجاد تغییرات شیمیایی در امینو اسید های رشته ی پلی پپتیدی است . این فرایندها برای فعالیت بیولوژیکی پروتئین ضروری هستند . بعنوان مثال باکتری ها توانایی ایجاد پیوند دی سولفید را ندارند اما پروتئین های جانوری حاوی تعداد فراوانی پل های دی سولفید هستند . اگر پروتئین ساختار سوم صحیح نداشته باشد بصورت غیر فعال خواهد بود .
تولید پروتئین نوترکیب در سلول های یوکاریوتی
اصلیترین جایگزین برای باکتری ها بعنوان میزبان، یوکاریوت های میکروبی مانند مخمر هاو قارچ های رشتهای هستند. از انجایی که این میزبان ها به سلول های جانوری بسیار نزدیک هستند ، می توانند پروتئینهای نوترکیب کامل تر و با کارایی بیشتر نسبت به میزبان باکتریایی تولید کنند. پروتئین ها بصورت مشابه با پروتئین های موجودات عالی تر پردازش و تغییرات پس از ترجمه پیدا می کنند.
مخمر ساکارومیسس سروزیه یکی از میزبان های یوکاریوتی شناخته شده است. بازده تولید پروتئین نوترکیب در این مخمر بالاست اما تعداد قند هایی که به پروتئین اضافه می شود زیاد بوده و هایپرگلیکوزیلاسیون ایجاد می شود همچنین فاقد سیستم مناسبی برای ترشح پروتئین به محیط کشت است که تخلیص را مشکل می کند.
پیکیا پاستوریس Pichia pastoris گونه ی دیگر مخمر است که توانایی تولید بالای پروتئین نوترکیب را دارد. مهمترین مزیت این گونه گلیکوزیلاسیون پیکا پاستوریس شباهت زیادی با سلولهای جانوری دارد. اگر پروتئین های تولید شده در این گونه را به خون تزریق شود خاصیت آنتیژنی ندارند.
آسپرژیلوس نیدولانس و تریکودرما رسئی از قارچ های رشته ای هستند که در کلون سازی مورد استفاده قرار می گیرند. این قارچ ها هم گلیکوزیلاسیون مناسب و هم خاصیت ترشح به محیط کشت را دارند.
اگرچه میزبان های میکروبی گزینه مناسبی در کلون سازی هستند اما برای تولید پروتئین هایی که ساختار گلیکو زیلاسیون پیچیده و ضروری دارند کارایی نداشته و سلول های جانوری میزبان مناسبتری هستند. برای کلون سازی در اینگونه سلول ها از ناقل های بیانی وپروموتر های قوی مانند SV40 ، CMV و RSV استفاده می شود .پروتئین های حاصل در این سیستم انچنان پرازش درست و بی نقصی دارند که قابل شناسایی از پروتئین های غیر نوترکیب نیستند. یکی از ایرادات وارد به این سیستم هزینه بالای آن است.
سلول های حشرات جایگزین مناسبی برای سلول های پستانداران محسوب می شوند و امکان تولید بالای پروتئین نوترکیب را دارندمانند کرم ابریشم.
پروتئین های نوترکیب حاصل از حیوانات و گیاهان زنده
یک جانور ترانس ژن یک ژن کلون شده در تمام سلول هایش دارد . بعنوان مثال از موش برای مطالعه عملکر ژن های انسان استفاده می شود . به درون سلول تخم لقاح یافته با استفاده از ریز تزریق ژن مورد نظر را وارد کرده و حیوان ترانس ژن ایجاد می شود. در موش این روش بخوبی جواب می دهد اما در پستانداران دیگر فرایند پیچیده تری لازم است . ابتدا ژن بیگانه را وارد سلول سوماتیک کرده و از انجایی که سلول سوماتیک به جانور کامل تبئیل نمی شود ، هسته ی آن را به درون سلول تخمی که هسته ی آن خارج شده انتقال می دهند . در ادامه سلول را در دستگاه تولید مثلی مادر قرار داده و سلول نوترکیب توانایی تقسیم و تمایز به جانور کامل را دارد و جانور حاصل در تمامی سلول های خود یک نسخه از ژن کلون شده را خواهد داشت .با اینکه این مسیر هزینه ی بالایی دارد اما چون طبق قانون مندل جانور توانایی ژن را به نسل های خود دارد ، معقول بنظر می رسد . بعنوان مثال می توان به گوسفند و خوک اشاره کرد . ترنس ژن تحت کنترل پروموتر ژن بتا لاکتو گلوبولین قرار گرفته و چون این پروموتر در بافت پستان فعال است به همین دلیل امکان ترشح پروتئین نوترکیب در شیر وجود دارد. از انجایی که تولید شر توسط حیوان محدودیت نداشته و تا پایان عمر ادامه می یابد امکان تولید مقادیر بالایی از پروتئین نوترکیب فراهم می شود .همچنین در خوک و گوسفند پروتئین انسانی به درستی پردازش میشوند و تولید پروتئین های انسانی مورد نیاز در علوم پزشکی در حیوانات مزرعه (فارمینگ ) گزینهی مناسبی است .

بیان ژن نوترکیب در گیاهان
از آنجایی که گیاهان و جانوران فرایند پردازش مشابهی دارند با تفاوتی کم در گلیکوزیلاسیون ، گیاهان میزبان مناسبی به شمار می آیند. ذرت ، تنباکو ، موز ، گوجه فرنگی ، برنج و نیشکر از جمله ی این گیاهان محسوب می شوند . بیان ترنس ژن در داخل بعضی از اندام های گیاهی کار تخلیص را سهل می کند . مثل دانه ، ریشه های مویین و ....
وقتی ژن مورد نظر تحت پروموتر ژن مخصوص دانه قرار می گیرد ،پروتئین نوترکیب در دانه تولید شده و با توجه به شکل تجمعی آن ، جمع آوری و پردازش پروتئین حاصل به سهولت انجام می شود . بطور کلی فارمینگ با استفاده از گیاهان که میزبان ژن خارجی هستند راه ر ا برای تولید واکسن های نوترکیب فراهم کرده است .سهولت کشت و جمع اروری گیاهان از مزیت های این میزبان می باشد. برای اثر بخشی کامل یک واکسن نیاز است تا مقدار واکسن 8-10 درصد TSP یا محتوای پروتئین محلول گیاه باشد که در واقع بازده بسیار کمتر از این میزان است . اما با در نظر گرفتن راه حل هایی می توان این میزان را بهبود بخشید . از مهمترین مزایای سیستمهای بیانی مبتنی بر گیاهان می توان به مقرون به صرفه بودن سیستمهای گیاهی، عدم آلودگی پروتئینهای نوترکیب تولید شده از گیاهان با میکروارگانیسمهای بیماریزای انسانی بدلیل اینکه پاتوژن مشترکی ندارند ، آسانی و کم هزینه بودن استحصال و تخلیص پروتئین های نیازمند پردازش های پایین دستی در گیاهان و انجام بیشتر تغییرات پس ترجمه ی مورد نیاز برای پایداری و فعالیت پروتئین توسط گیاهان اشاره کرد. علی رغم پیشرفت های بسیار امیدوار کننده در حوزه زراعت مولکولی هنوز با دو چالش جدی وجود دارد : سطوح تجمع ناکافی پروتئین های نوترکیب و فقدان روش های تخلیص کارآمد, که لازم است مورد توجه جدی قرار گیرند. برای دستیابی به سطوح بالای تولید, فاکتورهای متعددی از قبیل: انتخاب پروموتر قوی یا عناصر افزایش دهنده مناسب, اپتیمایز کدون ها , انتخاب اندام های مناسب, استفاده از رویکرد پروتئین فیوژن بایستی در نظر گرفته شوند. در صنعت داروسازی به طور معمول, از روش های کروماتوگرافی برای تخلیص پروتئین های نوترکیب استفاده می شود.نه تنها تولید پروتئینهای دارویی (مانند انسولین، انواع هورمون های رشد، آلبومین خون انسان و ... ) بلکه تولید محصولات صنعتی (مانند آنزیم های موجود در پودر های لباسشویی و آنزیم های مورد استفاده در صنایع چوب و کاغذ) نیز از نظر اقتصادی در گیاهان قابل توجیه است.
